发布日期:2024-06-27 来源:学科建设办公室 浏览量:
近日,爱思唯尔旗下期刊《Nano Today》(IF=13.2)在线发表了我校药剂学科罗聪/张申武团队的最新研究成果“A molecularly tailored closed-loop tumor cell energy nanodepleter for cancer starvation therapy”,我校无涯创新学院罗聪教授为本文通讯作者,2023级博士生孙新新和张申武教授为本文共同第一作者,沈阳药科大学为第一通讯单位。
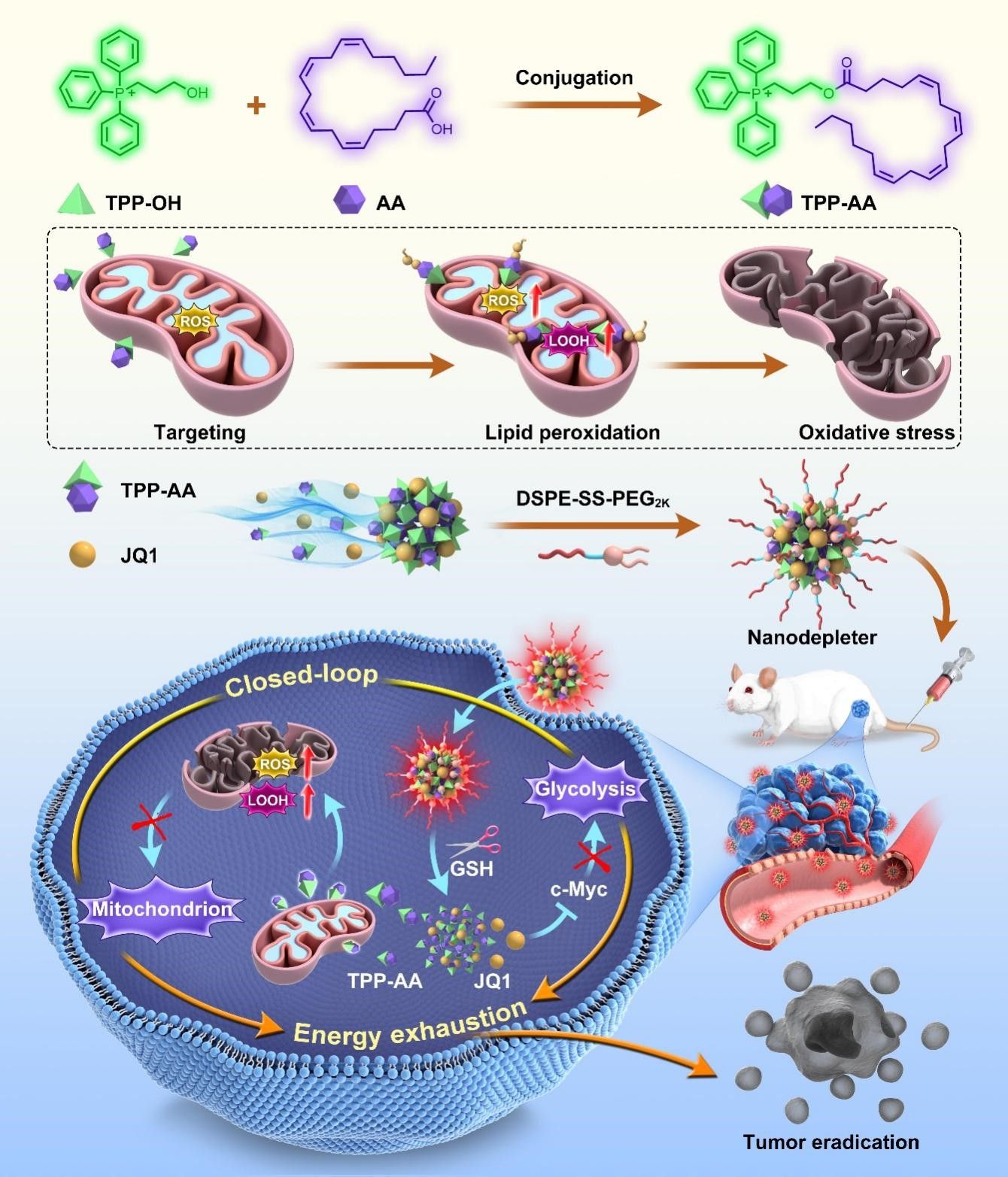
鉴于正常细胞和肿瘤细胞之间存在巨大的代谢差异,以干扰肿瘤能量代谢为中心的诱导饥饿治疗策略作为新兴的抗癌模式受到了广泛关注。然而,厌氧糖酵解和线粒体氧化磷酸化之间固有的互补性,导致诱导肿瘤能量耗竭的治疗策略的有效性面临着肿瘤细胞中普遍存在的双重能量供应模式的相互补偿机制的实质性障碍。随着纳米技术的不断发展,无载体纳米药物递药系统在药物递送方面显示出潜力。其中,无载体共组装纳米递送系统是由两种或两种以上药物共组装形成的不依赖载体材料的新型纳米制剂,具有制备简单、药物共载效率高、药代动力学匹配、肿瘤特异性积累和药物同步释放等多重优势。在无载体纳米共组装体表面修饰少量的DSPE-SS-PEG赋予纳米组装体还原响应释药特性,为高效低毒的抗肿瘤药物联合递送提供优良的技术平台。
在这项研究中,该团队首次以三苯基膦(TPP)和无细胞毒性的花生四烯酸(AA)合成了一种功能性偶联物(TPP-AA),在线粒体内高活性氧(ROS)水平下氧化AA后引发肿瘤特异性线粒体氧化损伤。与AA相比,TPP-AA不仅对肿瘤细胞的细胞毒性提高了50倍以上,而且在药理学上可达到的浓度下,对正常细胞的细胞毒性可以忽略不计。此外,该团队首次提出了利用双向闭环纳米耗竭器,系统地阻断糖酵解/线粒体对肿瘤的能量供应。其中,纳米耗竭器由JQ1(一种糖酵解抑制剂)和功能偶联物(TPP-AA)组装而成。值得注意的是,将TPP-AA制备成PEG化纳米组装体,极大地降低了TPP的阳离子毒性。在肿瘤高谷胱甘肽(GSH)条件下,释放出TPP-AA和JQ1。随后,TPP-AA通过引发线粒体功能障碍阻断线粒体氧化磷酸化;同时,JQ1通过下调肿瘤细胞中c-Myc抑制糖酵解途径,两者发挥高效协同抗肿瘤作用,在多种荷瘤小鼠模型中均显著抑制肿瘤生长。
本工作得到了国家自然科学基金(No. 82161138029、No. 82204317)等项目的支持。
原文链接:https://doi.org/10.1016/j.nantod.2024.102374.



 当前位置:
当前位置: